GENERALIDADES
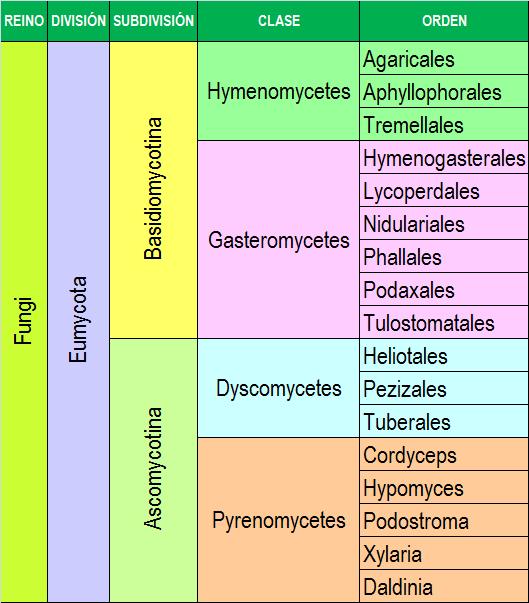
La ciencia que estudia los hongos es la Micología. Los hongos se pueden clasificar en dos grandes grupos:
Levaduras: unicelulares
Mohos: pluricelulares
En general, todos los hongos son heterótrofos, precisan compuestos orgánicos que contengan carbono como fuente de energía, son aerobios o anaerobios facultativos y, la mayoría de ellos viven como saprofitos en el suelo y agua.
Para la identificación de levaduras se recurre a pruebas bioquímicas similares a las que se utilizan para las bacterias, sin embargo, los mohos se identifican en base a su aspecto físico, lo que incluye las características de las colonias y la formación de esporas. Las colonias de mohos se describen como estructuras vegetativas porque están compuestas de células implicadas en el catabolismo y en el crecimiento. Los hongos suelen reproducirse por esporas.
ESTRUCTURAS VEGETATIVAS:
MOHOS
El TALO o COLONIA de moho consiste en largos filamentos celulares agrupados. Estos filamentos se llaman HIFAS. En la mayoría de los mohos las hifas contienen unos tabiques llamados SEPTOS que dividen a las hifas en unidades diferenciadas, mononucleares, semejantes a células. Este tipo de hifas se denominan HIFAS TABICADAS, sin embargo, en algunas clases de hongos la hifa no contiene tabiques y aparecen como largas células continuas con numerosos núcleos. Estas se conocen como HIFAS CENOCÍTICAS. Las hifas del talo crecen alargándose por sus extremos. Cada parte de una hifa es capaz de crecer y, cuando se separa un fragmento, puede alargarse para formar una nueva hifa. Cuando las condiciones ambientales son apropiadas las hifas crecen, se entrelazan y forman una masa llamada MICELIO. La parte del micelio implicada en la obtención de nutrientes de llama MICELIO VEGETATIVO y la relacionada con la reproducción MICELIO REPRODUCTOR o AEREO, llamado así porque se proyecta sobre la superficie del medio en el que crece el hongo.
LEVADURAS
Son hongos unicelulares no filamentosos, con una morfología característica esférica u ovalada. La mayoría de las levaduras forman colonias de organismos unicelulares y la colonia crece a medida que aumenta el número de levaduras. Este aumento suele ocurrir por gemación. En la gemación, la célula forma una protuberancia o yema sobre su superficie externa. Algunas especies de levaduras forman yemas que no logran separarse y dan lugar a una corta cadena de células llamada "Pseudohifa".
Las levaduras son capaces de crecer como anaerobias facultativas. Si disponen de oxígeno, realizan la respiración aeróbica para metabolizar azúcares hasta CO2 y H2O. Por el contrario, si carecen de oxígeno, fermentan azúcares produciendo Etanol y CO2.
HONGOS DIMÓRFICOS
Algunos hongos y especialmente, las especies patógenas, muestran dimorfismo, es decir, dos formas de crecimiento. Estos hongos pueden crecer como moho o como levadura. A menudo, este dimorfismo depende de la temperatura de incubación: a 37ºC el hongo es levaduriforme mientras que a 25ºC es filamentoso.
TOMA DE MUESTRAS
Muestras de la Piel: se deben recoger abundantes escamas de la zona lesionada, preferiblemente de los bordes o bien pasar un trozo de moqueta especial y estéril varias veces por la lesión.
Muestras de la Cabeza: recoger las escamas, los pelos (con raíz) o pasar la moqueta.
Muestras de las Uñas: tomar fragmentos pequeños de las uñas, o un raspado subungueal. Si hay un exudado perungueal se recogerá la muestra con una torunda estéril.
Lesiones en pliegues (interdigitales, unguinales, submamarios, labiales,...): recoger escamas o pasar la moqueta. Si la lesión es exudativa y no se pueden recoger escamas, la muestra se tomará con una torunda o mediante pases de moqueta.
Lesiones en mucosas oral, balanoprepucial, etc: se recogerá un exudado mediante una torunda. Se tomarán preferiblemente dos muestras, una para examen microscópico y otra para la siembra en un medio de cultivo.
Es importante que si las lesiones tienen más de una localización, se realicen tomas separadas. Además, en los volantes deberá aparecer la fecha de la toma de muestra, la localización de la lesión y tipo de muestra que se ha tomado, junto con otros datos de interés personales.
MATERIALES Y REACTIVOS
Portas y Cubres
Placas de petri estériles
Torundas
Bisturí y pinzas de disección
Espátulas de siembra
Asas de siembra
Pipetas estériles y no estériles
Papel celo
Cinta adhesiva
Guantes
Laca de uñas para sellar portas
REACTIVOS
Suero salino
KOH (Hidróxido potásico) ó Dimetil Sulfóxido
Azul Algodón Lactofenol: colorante para el examen directo o para teñir hongos de un medio de cultivo.
Tinta china
Alcohol de 70º.
MEDIOS DE CULTIVO
Para el aislamiento primario de los hongos, se utilizan diversos medios de cultivo. Estos medios hay que seleccionarlos en función del hongo que se sospeche y del tipo de muestra.
Los medios de cultivo se pueden utilizar en tubos cerrados con tapón de rosca o en placas de petri. La gran superficie de estas últimas facilita el aislamiento y la dilución de sustancias inhibitorias en las muestras. Es importante que el medio no se deseque por lo que el espesor de las mismas debe ser por lo menos de 25 mm, aproximadamente 35-40 mL de medio. Las placas se contaminan con facilidad durante la incubación por lo que es aconsejable sellarlas con cinta adhesiva. Los medios en tubo tienen la ventaja de que no se deshidratan y se contaminan menos, pero en cambio tienen menos superficie.
Si la muestra es de una zona contaminada se deben incluir medios que contengan Cloranfenicol y Cicloheximida. El primero inhibe los contaminantes bacterianos y el segundo inhibe el crecimiento de hongos saprofitos. Hay algunas especies patógenas que pueden ser inhibidas por ambos, por esta razón es importante usar medios con y sin agentes inhibidores. Las muestras de zonas estériles pueden inocularse en medios sin sustancias inhibitorias.
La temperatura de incubación debe ser seleccionada teniendo en cuenta el tipo de hongo, en general, los medios deben incubarse a 25ºC y a 37ºC durante 4 semanas antes de considerarse como negativos. Si se emplean tubos con tapón de rosca deben estar flojos para permitir la entrada de aire.
Medios más utilizados
Agar Dextrosado de Saboureaud con Cicloheximida y Cloranfenicol: se utiliza para el aislamiento e identificación de dermatófitos y Cándidas.
Agar Dextrosado con Cloranfenicol sin Cicloheximida: se utiliza para el aislamiento e identificación de patógenos ambientales y oportunitas.
Agar de harina de maíz ("Corn Meal Agar"):
Suplementado con Tween 80: para diferenciar distintas especies de Cándida y para realizar subcultivos ya que estimula la esporulación de hongos miceliales.
Suplementado con 10 gramos de Glucosa: para diferenciar Trichophyton
Agar de Urea: se utiliza para diferenciar entre levaduras e identificar diferentes especies de Trichophyton.
TÉCNICA DE SIEMBRA Y PROCESAMIENTO
El procesamiento debe ser inmediato. Muchas muestras se pueden sembrar inmediatamente tras su recogida.
Se debe sembrar la muestra en su totalidad. En caso de aspirado de abscesos, médula ósea, líquido cefalorraquídeo, etc, el volumen deberá ser de al menos 2 mL.
En el caso de que la muestra proceda de exudados vaginales: agitar la torunda en 0,5 mL de agua y sembrar, o bien sembrar con la torunda directamente.
En el caso de líquidos corporales se deberán tomar más de 2 mL y si en los líquidos hay coágulos o material membranoso, será necesario fragmentarlos con el bisturí y luego realizar la siembra.
Cuando la muestra son pelos y raspados: depositar directamente en el medio, presionando para que queden adheridos. En caso de uñas se pueden pulverizar o cortar en fragmentos.
Por último, cuando se trata de cepillados bronquiales, hay que mezclar con agua destilada y sembrar el volumen total (más de 1 mL).
Siembra con concentración
Se realizan siempre que la muestra es líquida y se hace por centrifugación a 1500-2000 r.p.m. durante 10 minutos. El sedimento se utiliza para un examen directo o bien para cultivo.
En líquidos corporales: el volumen tiene que ser mayor de 2 mL. Se fragmenta y se centrífuga. Si las muestras son muy densas, hay que diluirlas con agua destilada y centrifugar.
En orina: volumen superior a 2 mL
En LCR: centrifugar el LCR durante 10 minutos a 1500-2000 r.p.m. Retirar el sobrenadante con una pipeta estéril y resuspender el sedimento con el líquido que ha quedado. Sembrar.
Siembra con machacado u homogeneización
Se realiza en biopsias, muestras procedentes de tejidos y uñas. Se realizan con el fin de aumentar la superficie de la muestra, para lo cual cortamos en pequeños fragmentos que depositamos en una placa de petri estéril que contiene una cantidad de agua destilada estéril.
En el caso de las biopsias, homogeneizar en un triturador de tejidos. Primero cortamos la muestra, la mezclamos con agua destilada, trituramos y sembramos los medios con el homogeneizador y con pequeños fragmentos de tejido.
Incubar a 37ºC durante 3 semanas. Un error habitual es tirar los medios una vez que se ha conseguido el aislamiento de algún hongo, ya que puede haber otros de crecimiento más lento.
EXAMEN MICROSCÓPICO DIRECTO
Se realiza a partir de muestras obtenidas de lesiones. Es el método más simple y más rápido para establecer un diagnóstico presuntivo de micosis, ya que no necesita de incubación. Si la muestra no es abundante hay que dar prioridad al cultivo, frente al examen directo.
Preparación de la muestra:
En el caso de tejidos: cortar, trocear, machacar, etc.
En el caso de líquidos: concentrar por centrifugación.
En el caso de uñas: trocear, repartir en fragmentos, etc.
Si son otras muestras como escamas, pelos, etc, no es necesaria una preparación previa, sino que se hace directamente el examen.
TÉCNICAS Y TINCIONES PARA EL EXAMEN DIRECTO
Examen Directo con Solución Salina
Colocamos una gota de la muestra líquida en un porta y añadimos una gota de solución salina. Ponemos el cubre y observamos al microscopio con poca luz y variando el aumento.
Los hongos se observan refráctiles o brillantes, ligeramente verdosos. En el caso de las levaduras pueden aparecer inclusiones. También se pueden observar burbujas de diferentes tamaños. No debemos confundir las levaduras con hematíes y con burbujas de aire. Se diferencian porque las levaduras presentan pequeñas inclusiones en la célula y las burbujas van a ser siempre de diferentes tamaños.
Hidróxido Potásico con Dimetil Sulfóxido
No es necesario calentar la preparación, de esta forma no aparecen precipitados. Las muestras de pelos, escamas y biopsias se observan con poca luz.
Es importante no confundir artefactos como fibras de tejidos, granos de polen, etc, con hongos. Otra causa de error es lo que se denomina "hongos en mosaico", que suele aparecer cuando las muestras están muy queratinizadas. Suelen ser acúmulos lipídicos que desaparecen cuando se calienta la preparación.
Colocamos la muestra en pequeñas porciones sobre un porta y añadimos varias gotas de KOH + Dimetil y ponemos el cubre. Observamos los elementos fúngicos (hifas, levaduras, etc).
Si la muestra observada son uñas muy queratinizadas, el tiempo que actúa del KOH es de varias horas. Es conveniente dejar el porta en una cámara con ambiente húmedo (placa de petri con un algodón empapado en agua dentro).
Azul Algodón de Lactofenol
Se realizan las preparaciones a partir de cultivos. El fenol destruye la flora acompañante y organismos; el ácido láctico conserva las estructuras fúngicas y el azul algodón tiñe la quitina de las paredes fúngicas.
Añadimos una gota de la muestra o una porción del hongo en un porta. Sobre ella colocamos una gota de azul algodón y ponemos el cubre. Observamos al microscopio.
Blanco de Calcofluor
Se realiza un examen directo sea cual sea la muestra. Es útil en cortes de tejidos.
Colocamos en un porta la muestra + 1 gota de KOH dimetil sulfóxido + 1gota de calcofluor. Mezclamos y ponemos el cubre. Después de varios se ha producido la clarificación, y se observa en un microscopio de fluorescencia (verde brillante o blanco azulado). Las fibras elásticas y colágeno se observan con fluorescencia amarillo verdosa. Estas se pueden confundir con hongos y levaduras y se diferencian en la fluorescencia.
Hay algunos hongos ("hongos dematiaceos") que producen enfermedades como micetomas que se tiñen con gran dificultad usando el blanco de calcofluor.
Colorante de Cobre ( tinta parker-KOH)
Para el diagnóstico de Malassecia furfur se tiñen intensamente de color azul. La tinta china se utiliza en muestras de LCR y exudados. La usamos siempre que busquemos Criptococcus neoformans.
La técnica consiste en añadir 1gota de tinta china junto con 3 gotas de la muestra, dejar reposar, apareciendo un color marrón (la cápsula se rodea con un halo blanco).
Tinción de Gram
Se realiza para la identificación de hongos. Suelen ser Gram+ y la única consideración a tener en cuenta es que el cristal violeta hay que mantenerlo por más tiempo.
Otras técnicas histológicas o tinciones: Plata Metalamina; Hematoxilina; Tinción Wright.
EXAMEN DIRECTO Y CULTIVO
Las muestras a partir de las cuales se realizan son:
Exudados óticos
Secreciones respiratorias
Biopsias
Cepillados esofágicos
Escamas
Pelos y uñas
NO EXAMEN DIRECTO PERO SÍ CULTIVO
Exudado balanoprepuciales
Exudado bucal-lingual
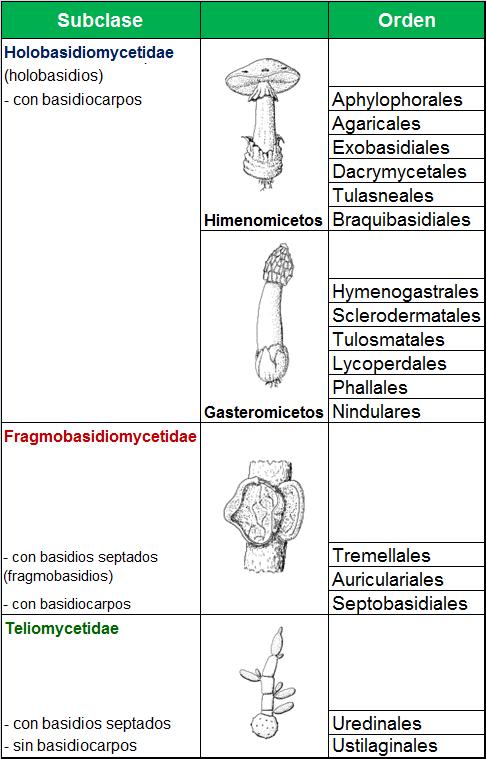
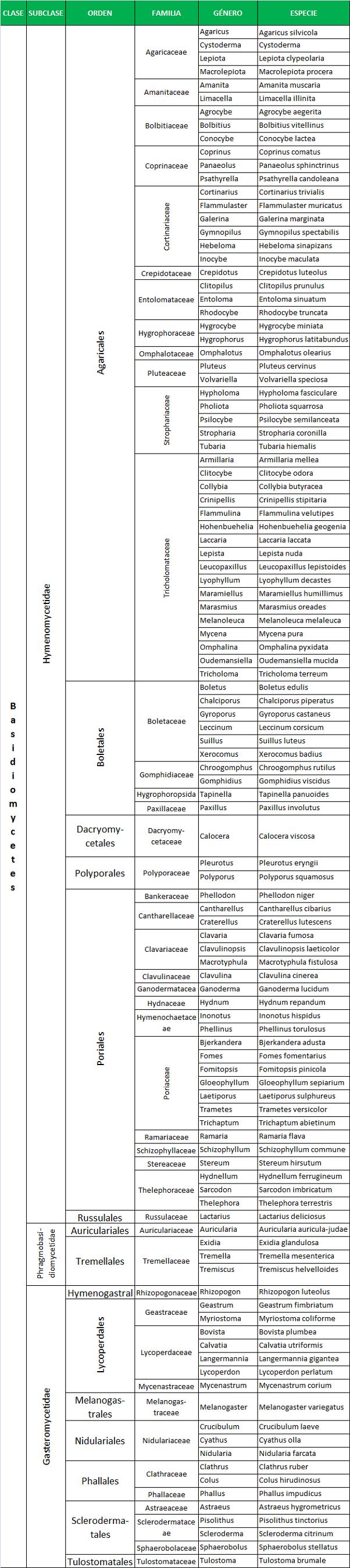
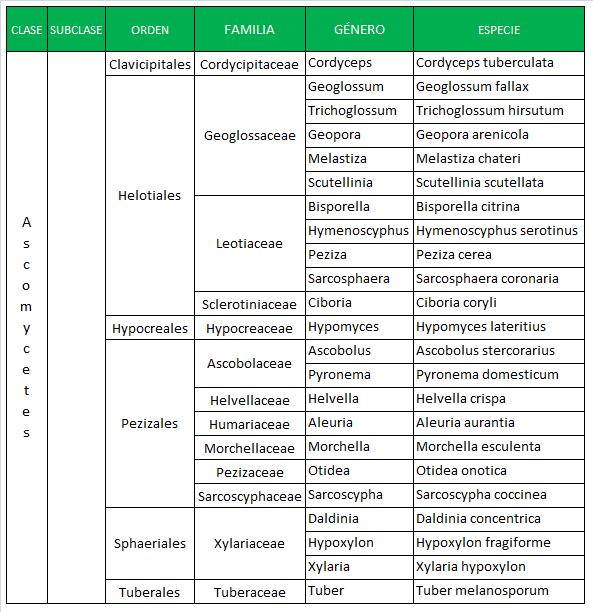
IDENTIFICACIÓN DE HONGOS MICELIALES
La identificación se hace en base a su morfología, que puede ser macroscópica y microscópica y que varía en función del medio de cultivo, tiempo y temperatura de incubación.
La velocidad de crecimiento varía según el hongo:
Hongos miceliales:
No dermatófilos ! crecen rápido 3-5 días
Dermatófilos ! 1-3 semanas
CARACTERÍSTICAS MACROSCÓPICAS
Textura de la colonia (mirar fotocopia 1):
Algodonosa: micelio denso y largo
Glabra: consistencia cérea. No micelio aéreo
Aterciopelada: micelio aéreo corto
Pulverulenta: gran cantidad de esporas y conidias
Coloración
CARACTERÍSTICAS MICROSCÓPICAS
TÉCNICA CON PAPEL DE CELO CON AZUL
Cogemos un trozo de celo tocamos suavemente la parte superior del hongo del que queremos observar sus características microscópicas y lo colocamos sobre un porta al que anteriormente habíamos añadido una gota de colorante azul algodón de lactofenol. Observamos al microscopio con el objetivo de 40x o 100x.
CULTIVO O MICROCULTIVO EN PORTA
No se alteran las estructuras fúngicas. Se utiliza un medio Saboraud que se vierte sobre una placa de petri (capa delgada). Una vez solidificado cortamos cuadrados con un bisturí estéril de 1-3 cm y los colocamos en un porta estéril o flameado. El porta estará colocado en una placa de petri estéril, sobre un soporte. En el fondo de la placa añadiremos unas gotas de agua para evitar la desecación durante la incubación.
Inoculamos o bien las esquinas, o bien los bordes del agar con el hongo a estudiar. Tomamos la muestra con un asa estéril humedecida con agua. Sellamos las placas con parafilm y llevamos a incubar.
EXAMEN DE FRAGMENTOS DE COLONIAS AL MICROSCOPIO
Mediante esta técnica se rompen los conidios y las esporas. Consiste en cortar con el asa un fragmento de la colonia en el borde (asa en forma de cuña) y depositarlo sobre un porta con una gota de azul de lactofenol. Si se ha incluido agar, calentar suavemente para fundirlo y aplastar el cubre.
TÉCNICA PARA CONFIRMAR EL DIMORFISMO
Consiste en incubar la misma muestra a 25ºC, temperatura a la que crecen los hongos miceliales, y a 37ºC temperatura a la que crecen las levaduras (tejidos o medios especiales).
Las especies más importantes dimórficas son: Histoplasma capsulatum, Blastomyces dermatidis, Paracoccidioides brasiliensis, Coccidiodes imitis. Penicillium marneffei, Slorothrix schenckii.
Para la confirmación es necesario convertir la fase filamentosa en levaduriforme. Para ello incubamos parte de la colonia micelial en una placa de Agar Sangre (3-4 fragmentos). Sellamos e incubamos a 37ºC. Examinamos periódicamente el crecimiento buscando levaduras. Si crece colonia micelial repetimos la siembra hasta conseguir fase levaduriforme.
MEDIOS DIFERENCIALES
Resistencia a Cicloheximida Actidiona:
Dermatofitos y hongos dimórficos ! resistentes a 30ºC
Zigomicetos, algunas levaduras, mayoría de agentes micetomas! inhibidos
Agar Maíz (patata, arroz): permite la esporulación de hongos
Desdoblamiento de urea: permite identificar especies de Trichophyton incubando a 25ºC / 7 días.
IDENTIFICACIÓN DE LEVADURAS
Test de filamentación
Preparamos una suspensión de levaduras en 0.5-1 mL de suero de conejo e incubamos a 35-37ºC no más de 3 horas.
Transcurrido el tiempo observamos al microscopio la presencia o ausencia de tubos germinales, es decir, de filamentos que no constriñen su punto de origen en la levadura.
El test será POSITIVO si se observan los tubos germinales (C. albicans)
El test será NEGATIVO cuando no encontremos los tubos germinales ((otras especies de Cándida).
Medio diferenciador para levaduras
Posee cromógenos que colorean las colonias según la especie. En el caso de la Cándida albicans, las colonias son de color azul.
Asimilación de azúcares (API)
Técnicas inmunológicas y moleculares
Se utilizan para el estudio de hongos que producen micosis invasivas. Detectan Ag del Criptococo (hongo que produce una cápsula con el Ag en su interior) en LCR o suero del paciente.
Victor Murillo
Electronica del estado solido